EL ÁTOMO ES EL COMPONENTE BÁSICO DE TODO EL UNIVERSO
 ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA
LAS PROPIEDADES DE UN ELEMENTO
ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA
LAS PROPIEDADES DE UN ELEMENTO
 EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA
EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA
 ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA
LAS PROPIEDADES DE UN ELEMENTO
ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA
LAS PROPIEDADES DE UN ELEMENTO
 EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA
EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA 
Historia del Átomo
 El Atomismo Griego
Los filósofos griegos DEMÓCRITO de Abdera y su maestro Leucipo, en el siglo V a.C. alguna vez se preguntaron:
El Atomismo Griego
Los filósofos griegos DEMÓCRITO de Abdera y su maestro Leucipo, en el siglo V a.C. alguna vez se preguntaron:
¿De qué están hechas las cosas?
Más adelante te contaré como termina esta historia, pero ahora ayuda a estos filósofos a resolver su predicamento, realizando la siguiente actividad (dale un clik a la actividad 1):
Hace 2500 años los pensadores griegos Democríto y su maestro Leucipo recolectaron varios objetos, al igual que hoy un niño pequeño destruye un objeto para ver de qué está hecho o cómo funciona; los filósofos comenzaron a romper sus materiales para descubrir su composición. Después de múltiples divisiones y utilizando las más variadas herramientas de su época, llegó un momento en el que las fracciones eran tan pequeñas que ya no podían ser cortadas. Comparando la última fracción de cada objeto concluyeron:
"Todos los objetos existentes están conformados
por pequeñísimas partículas indivisibles"
A esta última fracción los griegos le dieron el nombre de ATOMNÉ (a que significa sin, y tomne que significa corte, atomne quiere decir: sin corte).
La aportación de Demócrito y Leucipo a la historia del átomo, fue una nueva palabra o concepto: ÁTOMO, que significa "Indivisible"
 Primera Teoría Atómica
El concepto de átomo, que los griegos aportaron, prevaleció hasta finales del siglo XVIII. En 1809 el físico inglés JOHN DALTON meditó profundamente sobre la estructura de la materia y tras varios experimentos lo condujeron a postular la primer Teoría Atómica y con ella un primer modelo del átomo.
Teoría Atómica de Dalton
Primera Teoría Atómica
El concepto de átomo, que los griegos aportaron, prevaleció hasta finales del siglo XVIII. En 1809 el físico inglés JOHN DALTON meditó profundamente sobre la estructura de la materia y tras varios experimentos lo condujeron a postular la primer Teoría Atómica y con ella un primer modelo del átomo.
Teoría Atómica de Dalton
- Toda la meteria está formada por partículas extraordinariamente pequeñas, sólidas y esféricas llamadas átomos.
- Todos los átomos de un mismo elemento son iguales entre sí, particularmente en peso y volumen, pero diferentes a los átomos de otro elemento.
- La combinación de átomos da lugar a nuevas sustancias a las que llamamos compuestos.
- Los átomos permanecen indivisibles, incluso en las reacciones más violentas.
 Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2):
Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2):
 Carácter Eléctrico de Átomo
Las ideas de Dalton perduraron sin cambio durante casi 100 años. Fue hasta 1897 cuando el físico inglés JOSEPH JOHN THOMSON se dedicó a investigar el comportamiento eléctrico de la materia.
Carácter Eléctrico de Átomo
Las ideas de Dalton perduraron sin cambio durante casi 100 años. Fue hasta 1897 cuando el físico inglés JOSEPH JOHN THOMSON se dedicó a investigar el comportamiento eléctrico de la materia.
Pero mejor dejemos al propio J. J. Thomson contarte qué fue lo que hizo:
Por medio de un disparador de partículas (como los antiguos televisores de cinescopio), Thomson proyectaba los rayos sobre una pantalla fluorescente y las colisiones iluminaban la pantalla, a estos rayos Thomson los denominó "Rayos Catódicos"
Observa la imágen, medita y explica el experimento de Thomson
 Thomsom estaba seguro que el choque o colisión de los átomos sobre la pantalla estumulaban la fluorescencia o la ilumancacion.
Posteriormente Thomson sometió los rayos catódicos a los efectos de campos magnéticos y observó que el rayo se bifurcaba, desviando su trayectoria en dos sentidos. (NO es aconcejable, pero si haz tenido la experiencia de acercar un imán a la pantalla de tu televisor, habrás observado que se deforman las imágenes y los colores; ésto mismo hizo Thomson de manera controlada).
Thomsom estaba seguro que el choque o colisión de los átomos sobre la pantalla estumulaban la fluorescencia o la ilumancacion.
Posteriormente Thomson sometió los rayos catódicos a los efectos de campos magnéticos y observó que el rayo se bifurcaba, desviando su trayectoria en dos sentidos. (NO es aconcejable, pero si haz tenido la experiencia de acercar un imán a la pantalla de tu televisor, habrás observado que se deforman las imágenes y los colores; ésto mismo hizo Thomson de manera controlada).
Observa la imágen, medita y explica el experimento de Thomson
 Meditando los resultados de su experimento, Thomson concibió la idea de que el átomo propuesto por Dalton, efectivamente era una esfera pero que ésta tenía una carga positiva y que en ella se incurstaban pequeñas entidades desprendibles de carga negativa, a la que Thomson llamó: "ELECTRÓN".
Con todas sus demostraciones Thomson propuso un segundo modelo atómico conocido como "Gelatina con pasas" o "Panque con pasas", superando al modelo de Dalton y otorgándole propiedades eléctricas.
Meditando los resultados de su experimento, Thomson concibió la idea de que el átomo propuesto por Dalton, efectivamente era una esfera pero que ésta tenía una carga positiva y que en ella se incurstaban pequeñas entidades desprendibles de carga negativa, a la que Thomson llamó: "ELECTRÓN".
Con todas sus demostraciones Thomson propuso un segundo modelo atómico conocido como "Gelatina con pasas" o "Panque con pasas", superando al modelo de Dalton y otorgándole propiedades eléctricas.
 Una Mujer rompe el Átomo
Después de muchos años de estudio, tanto Demócrito, Dalton y Thomson coincidían en la idea de que el átomo era indivisible. Fue hasta 1895 cuando la polaca profesora en química MARIE CURIE demostró lo contrario: el átomo sí puede ser dividido.
Una Mujer rompe el Átomo
Después de muchos años de estudio, tanto Demócrito, Dalton y Thomson coincidían en la idea de que el átomo era indivisible. Fue hasta 1895 cuando la polaca profesora en química MARIE CURIE demostró lo contrario: el átomo sí puede ser dividido.
 ¿Recuerdas las cámaras fotográficas que utilizan rollos de película? Entonces sabes que si expones el rollo a la luz, tus fotos se velarán; esto mismo le sucedía al físico francés HENRI BECQUEREL cuando sus rollos, aún cerrados, estaban cerca de un mineral llamado pechblenda. Bequerel sospechó que sus rollos se velaban a causa de algún elemento desconocido presente en el mineral y encargó a la profesora en química Marie Curie, que tratara de descubrir este elemento.
Fue así como Madame Curie y su esposo Pierre se dedicaron a estudiar el mineral. Lograron identificar nuevos materiales que tenían la propiedad de radiar energía de manera espontanea, a esta propiedad los esposos Curie la lamaron Radiactividad. Tiempo después revelaron el descubrimiento de tres nuevos elementos, todos radiactivos: Radio (Ra), el más radiactivo de todos, el Uranio (U) y el Polonio (Po).
¿Recuerdas las cámaras fotográficas que utilizan rollos de película? Entonces sabes que si expones el rollo a la luz, tus fotos se velarán; esto mismo le sucedía al físico francés HENRI BECQUEREL cuando sus rollos, aún cerrados, estaban cerca de un mineral llamado pechblenda. Bequerel sospechó que sus rollos se velaban a causa de algún elemento desconocido presente en el mineral y encargó a la profesora en química Marie Curie, que tratara de descubrir este elemento.
Fue así como Madame Curie y su esposo Pierre se dedicaron a estudiar el mineral. Lograron identificar nuevos materiales que tenían la propiedad de radiar energía de manera espontanea, a esta propiedad los esposos Curie la lamaron Radiactividad. Tiempo después revelaron el descubrimiento de tres nuevos elementos, todos radiactivos: Radio (Ra), el más radiactivo de todos, el Uranio (U) y el Polonio (Po).
 Radiactividad: fenómeno natural que presentan algunos materiales y que consiste en la emisión espontanea de alta energía. Hoy sabemos que los elementos que tienen un número atómico mayor que 82 (es decir más de 82 protones en su núcleo), son radiactivos.
Radiactividad: fenómeno natural que presentan algunos materiales y que consiste en la emisión espontanea de alta energía. Hoy sabemos que los elementos que tienen un número atómico mayor que 82 (es decir más de 82 protones en su núcleo), son radiactivos.
Los elementos radiactivos desprende partículas Alfa (dos protones, dos neutrones y gran cantidad de energía), de modo que cuando un átomo irradia energía también se desintegra pierdiendo protones y con ello su personalidad, analicemos un ejemplo:
El Uranio (U) tiene un número atómico de 92 (recuerda que si el Número Atómico es mayor que 82, es un elemento radiactivo), cuando emite radiación, perderá dos protones y su número atómico cambia a 90, el elemento con número atómico 90 es el Torio (Th), a este fenómeno se le conoce como TRANSMUTACIÓN
Hoy en día se aprovecha la energía de los elementos radiactivos en plantas nucleoeléctricas controlando la radiactividad por medio de la Fisión y la Fusión Nuclear:
Veamos entonces qué tanto comprendiste de la radiactividad, realizando la siguiente actividad (dale un clik a la actividad 3):
 Más Partículas en el Átomo
Para 1909 el físico neozelandés ERNEST RUTHERFORD, encerró pechblenda en una caja de Plomo (Pb) para impedir la salida de radiación, perforó una pared de la caja, por donde escapaba la radiactividad y la observada sobre una pantalla fluorescente, sometió esa radiación a campos electromagnéticos y observó lo siguiente:
Más Partículas en el Átomo
Para 1909 el físico neozelandés ERNEST RUTHERFORD, encerró pechblenda en una caja de Plomo (Pb) para impedir la salida de radiación, perforó una pared de la caja, por donde escapaba la radiactividad y la observada sobre una pantalla fluorescente, sometió esa radiación a campos electromagnéticos y observó lo siguiente:
Observa la imágen, medita y explica el experimento de Rutherford
 Efectivamente, con este experimento Rutherford demostró que el átomo al desintegrarse emite tres diferentes clases de partículas o rayos: Uno se desviaba al campo electropositivo (los electrones) a los que Rutherford denominó: "Rayos Beta". Otro rayo se dirigía al campo electronegativo, al cual lo llamó: "Rayos Alfa", que posteriormente los llamaría: "PROTONES". Y un tercer rayo que era indiferente a los campos electromagnéticos, a esos Rutherford los llamó: "Rayos Gama", tiempo despues junto con el físico inglés James Chadwick los denominarón: NEUTRONES
Con otro experimento Rutherford bombardeó una delgada lámina de oro con rayos alfa (protones o partículas de carga positiva):
Efectivamente, con este experimento Rutherford demostró que el átomo al desintegrarse emite tres diferentes clases de partículas o rayos: Uno se desviaba al campo electropositivo (los electrones) a los que Rutherford denominó: "Rayos Beta". Otro rayo se dirigía al campo electronegativo, al cual lo llamó: "Rayos Alfa", que posteriormente los llamaría: "PROTONES". Y un tercer rayo que era indiferente a los campos electromagnéticos, a esos Rutherford los llamó: "Rayos Gama", tiempo despues junto con el físico inglés James Chadwick los denominarón: NEUTRONES
Con otro experimento Rutherford bombardeó una delgada lámina de oro con rayos alfa (protones o partículas de carga positiva):
Observa el video, medita y explica el experimento de Rutherford
Observando ésto, Rutherfor se pregunto: ¿por qué algunos protones atraviesan libremente la lámina de oro?, ¿por qué otros atraviesan la lámina pero desvían su trayectoria? y ¿por qué otros protones rebotaban en la lámina? ¿Tú qué te imaginas?
Al igual que tú, Rutherford concluyó:
- PRIMERO: Sí la lámina contiene átomos y los protones bombardeados no chocan con nada, puesto que pasan libremente, significa que hay espacio vacío entre un átomo y otro;
- SEGUNDO: Sí se está bombardeando con cargas positivas y al atravezar la lámina solo desvían su trayectoría, significa que el protón pasa rozando al átomo de oro al tiempo que es repelido. Se entiende entonces que los átomos en su parte central poseen cargas positivas (recuerda que en magnetismo y electricidad: signos o cargas iguales: se repelen; signos o cargas diferentes: se atraén);
- TERCERO: Los protones bombardeados que no logran atravezar la lámina y son rebotados, están chocando directamente con una región del átomo de gran tamaño o con gran cantidad de masa.

 Un Sistema Solar en el Átomo
El físico danés NIELS BÖHR en 1913 sugirió un nuevo modelo atómico basado en el modelo de Rutherford. Aplicando la recién Teoría Cuántica propuso que los electrones se encontraban girando al rededor del núcleo en determinadas y bien definidas regiones a las que Böhr llamó NIVELES DE ENERGÍA, contrario a la distribución caótica del modelo anterior. Böhr.
Un Sistema Solar en el Átomo
El físico danés NIELS BÖHR en 1913 sugirió un nuevo modelo atómico basado en el modelo de Rutherford. Aplicando la recién Teoría Cuántica propuso que los electrones se encontraban girando al rededor del núcleo en determinadas y bien definidas regiones a las que Böhr llamó NIVELES DE ENERGÍA, contrario a la distribución caótica del modelo anterior. Böhr.
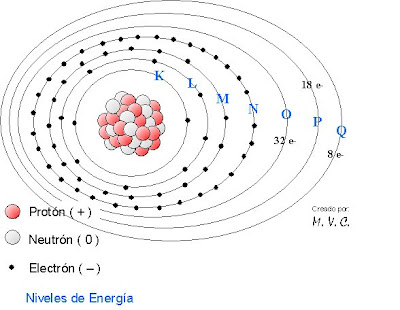 El Modelo Atómico de Böhr respetó la constitución del núcleo, pero acomodó los electrones en siete niveles de energía, a los cuales Böhr señaló con las letras mayúsculas:
El Modelo Atómico de Böhr respetó la constitución del núcleo, pero acomodó los electrones en siete niveles de energía, a los cuales Böhr señaló con las letras mayúsculas:- K: al nivel más cercano al núcleo y que se vincula directamente con el primer periodo de la tabla periódica;
- L: al segundo nivel o capa de electrones, relacionado con periodo dos de la tabla;
- M: al tercer nivel energético del átomo o 3er periodo de la tabla ;
- N: a la cuarta capa de electrones o 4o periodo;
- O: la quinto nivel o 5o periodo;
- P: al sexto nivel o 6o periodo, y;
- Q: al último nivel energétido, el más alejado del núcleo y que se relaciona con el séptimo periodo de la tabla periódica.
- En K, de un electrón y hasta dos electrones ( e- );
- En L, de uno y hasta 8 electrones;
- En M, de 1 e- y hasta 18 e- ;
- En N, de 1 e- y hasta 32 e- ;
- En O, 1 e- y hasta 32 e- ;
- En P, 1 e- y hasta 18 e- , y;
- En Q, 1 e- y hasta 8 e-
Vamos a elaborar algunos modelo atómico según Böhr,
con la siguiente actividad. (dale un clik a la actividad 4)
 Discretos Niveles de Energía
Para 1926 el austriaco ERWIN SCHRÖDINGER echó abajo los trabajos de Böhr al postular el Principio de Incertidumbre:
Discretos Niveles de Energía
Para 1926 el austriaco ERWIN SCHRÖDINGER echó abajo los trabajos de Böhr al postular el Principio de Incertidumbre:
"Es imposible conocer con exactitud la posición y velocidad de un electrón"
Partiendo de la teoría de onda - partícula, Schrödinger ideó un Modelo Atómico usando la Mecánica Cuantica Ondulatorio y conceptos matemáticos de probabilidad. Este modelo continua siendo la base de los conceptos modenos acerca de la estructura atómica y explica que los niveles de energía, propuestos por Böhr, están constituidos por subniveles de energía u orbitales, regiones aún más discretas que forman a las capas electrónicas o niveles energéticos.
Así como los niveles de Böhr, los subniveles de Schrödinger fueron denominados por letras, pero para diferenciarlos éstas fueron minúsculas:- s: del inglés "sharp", que significa agudo o cerrado;
- p: significa principal;
- d: del ingles "diffuse" que significa difuso;
- f: significa fundamental.
 Y al igual que las orbitas, los orbitales tienen una capacidad máxima de electrones:
Y al igual que las orbitas, los orbitales tienen una capacidad máxima de electrones:
- s: de un electrón y hasta 2 electrónes ( e- );
- p: de 1 e- y hasta 6 e- ;
- d: de 1 e- y hasta 10 e- , y;
- f: de 1 e- y hasta 14 e-
 En este último modelo del átomo, el principal interés es determinar dónde es posible encontrar un electrón.
Elaboraremos algunos modelos atómicos según la Teoría Mecánica Cuántica Ondulatoria (dale un clik a la actividad 5)
En este último modelo del átomo, el principal interés es determinar dónde es posible encontrar un electrón.
Elaboraremos algunos modelos atómicos según la Teoría Mecánica Cuántica Ondulatoria (dale un clik a la actividad 5)
ACTIVIDAD 5
"Configuración Electrónica"
Hasta aquí hemos recorrido la evolución que ha tenido el concepto de átomo, esperamos en lo futuro un nuevo modelo, o porque no desearlo, quizá se desarrolle alguna tecnología que nos permita observarlo directamente y confirmar o desmentir todo este viaje.
Espero que con este trabajo hayas comprendido la naturaleza íntima de la materia y no expliques la Teoría Atómica como lo hace nuestro primer actor mexicano Mario Moreno "Cantinflas"


33 comentarios:
Hola profe a mi en lo personal me gusto mucho por que me da a conocer las diferentes formas y distitos tipos de atomos y su estructura y que en todas partes hay una atomoy ps tambien me gusto la forma en que lo redacta usted bueno me voy se cuida bye
Dira Barreiro!!
Hola profesor!
como esta? espero que muy bien, pues antes que nada quiero darle las gracias por enseñarme tantas cosas.
EL blog me gusto mucho, porque no solo hablan de un tema, al contrario se van desarrollando diversos textos que la verdad estan muy interesantes. Cada dia me sorprendo mas, es increible todo lo que tiene El Àtomo.
Bueno eso es todo! cuidese mucho0o!
atte: Dira
Me parece una buena oportunidad para construir el conocimiento.
hOla profesOr:
A mi punto de vista esta demasiado
bien realizado este blog acerca del átomo ya que conocí demasiadas cosas que no recordaba ;ya que ya las había visto pero pues me di cuenta de que cada personaje tiene su diferente teoría acerca del atomo y su características hasta llegar al actual.
es todo!!
cuidese
byE!!*
hoola!!!
bueno el blog me parecio muy interesante por que contiene mucha informacion que aprendi como lo que es el atomo, varias teorias, y cosas como sabr utilizar la tabla periodica.
en mi opinion esta muy bien que nos de este tipo de medios para investigaciones y con informacion confiable, segura y muy completa
gracias
asta luego BYE
me parecio un tema muy bien explicado para la complejidad de un tema como lo es "el atomo"
y ademas bien formulado y redactado
atte:rafael
maximiliano
HOLA PROFESOR CERVANTES,LE ESCRIBO ESTE TEXTO PARA ENCOMIARLO POR HABER CREADO ESTE BLOG Y HABER DESARROLLADO ESTE TEMA QUE EN LO PARTICULAR ES DE MI INTERESANTES,PUES ES MUY DIFICIL ESPLICARLO DE FORMA VERVAL,PERO ESTE METODO ES MUY BUENO Y MUY VALIOSO,YA QUE EL TEMA DEL ATOMO ES UN TEMA MUY INTERESANTE Y ABARCA MUCHAS TEORIAS DE DIFERENTES CIENTIFICOS QUE TIENEN ALGO MUY EN COMUN:NADIE DE ELLOS PUDO AFIRMAR DONDO SE ENCUENTRAN LOS ATOMOS,Y SOBRE TODO,DONDE SE ENCUENTRAN LOS ELECTRONES,PERO ENSI,LE AGRADESCO POR LA EXPLICACION,Y TERMINO MI COMENTRIO.
ATT:JONATAN MARQUEZ CASTILLO JMC
TODOS HAGAN SU TAREA.
Hola Profesor... este BLOG me gusto mucho porque hablan de muchos temas en especial acerca del ÁTOMO y se me hicieron muy muy interesantes las ACTIVIDADES que nos dejó.
Bueno es todo... bye... Se cuida
ATTE: Carlos Alberto Alatriste Rivas
HOLA MAESTRO SOY SAUL CANUL DEL 3-A AL PARESER LE PONE MUCHO EMPECHO A SUS TRABAJOS Y SU PAGINA WEB Y PONE VIDEOS DE CANTINFLAS CONVINA LO CIENTIFICO CON COMICO.
ESTABIEN LO QUE NO ENTIENDO ES QUE SI UN ATOMO ES LO MAS CHIQUITO QUE PUEDE TENER ALGO ENTONSES QUE SON LO ELECTRONES Y LOS IONES ¿QUE NO SON MAS QUICOS DE LOS ATOMOS?SE LO DEJO DE TAREA heeeeeeeeeeeeeeee!
hola profesor solo paso para decirle que me interesa mucho este tema y por loque veo esta muy bien echo su blog lo felicito y tambien que que bueno que use lo comico para lo cientifico me agarda jajaja creo que ya es todo le mando un cordial saludo y un gran abrazo atentamente:samantha carbajal corzo 3a
Buenas tardes profe!! Espero se la esté pasando super este 14. Bueno pues yo opino que igual existen demásiadas preguntas acerca de tantas cosas que existen en todo el Universo, pero como simpre la mente humana desde nuestros inicios prehistóricos, la curiosidad y el entusiasmo por saber la composición del medio en el que nos desarrollamos ha sido evidente; y tal es el caso de estos famosos griegos: "Demócrito y Leucipo", por su grande aportación al estudio del átomo.
Ésta actividad fue precisamente una invitación a descubrir un poco de la composición de algunos materiales que se encuentran presentes a nuestro alrededor, claro aunque ya muchos fueron descubiertos desde tiempo atrás, y muchos más hay por descubrir, aunque pienso que el conocimiento jamás se termina; como los números que son infinitos, asi es igual el conocimiento. Muy interesante la actividad!!
Sin mas ni menos que decir...hasta luegoO!
Atte: Jessica León de 3ro "A"
hola maestro como esta soy carlos hays y la verdad su platica esta tan interesante que me dio flojera leerla pero lo tube que ase jajajaja bueno ley como la mitad i la vardad es cierto todo lo que dice por que es muy imprecionante como puede a ver tremenda cantidad de atomos es impresionante y espero que me resuelva mis dudas aunque no tenga dudas ajjajjajaja bueo adios CARLOS HAYS 3-A
hola profe como esta?
bueno ami me gusta mucho su blog
y ahora estos temas se me hacen muy interesantes y son especial los atomos y sus formas se me hacen interesantes y lo que mas me gusto es el video de cantinflas jeje
bueno maestro lo dejo bye
sara rabago 3°a
hola maestro me gusto sus temas que se me hacen muy interesantes mas la de la teoria atomica y sus dibujos estan chidos
soy jorge de 3 A
SOY raul torres gomez de 3ro ¨c¨ y el video de modelos atomicos de thompson confuso por el lenguaje y los subtitulos y por eso no le en tendi casi nada solo sobre la parte en la que dice que hay una sobdivision del atomo y el aparato que el utilizo pero lo malo es que el procedimiento es muy enredado
hola maestro estubo muy dificil entender el video de thomson solamente entedi que thomson toco un acelerador de particulas casi no le entendi pero hice lo que pude soy daniela garduño de 3:C
maestro hola como esta aqui me tiene redactando por un diez jajajjajajjja bueno maestro este comentario es por lo de la teoria da thomson que la verdad no entendi nada pero lo que capte es que creo una maquina pequeña que creo refrectaba alo atomo y electrones creo y algo que me di cuenta que thomson no tiene mucho que murio por que hay videos de el en blanco y negro y se ve muy bn y para que no diga que no nutrimos su blog ay le va maestro yo creo que actualmente hay videos de todo tipo usted puede poner cualquier tonteria y le salen muy buenas redaccciones bueno maestro muchas gracias y adios
CARLOS HAYS 3_A
Holaa proofee!
aaa pues la verdad no entendi el video que thomson toco un acelerador de particulas y eso fue lo poco q entendi aa jajaja
buenoo habeer si lo puede explicar en español y mas dinamico va??
adIos :]
hola profe.
La verdad se me hizo muy facil entender el video, no por el ingles xD si no por el otro idioma.
Entendi que thomson fue uno de los primero que en Cambriedge descubrio que habian partículas menores dentro de loos átomos.
Que utilizo uno de aparato para acelerar las particulas a un alto voltaje.
atte: karla B 3º "A"
¡Profesor! ¿Cómo está? Espero que bien.
La verdad, es increíble como algo tan diminuto como un átomo ha movido a la gente, intentando descubrir más sobre ellos. Pareciera que cada vez que se conocía un poco más de ellos, haciendo creer que ya no se podría saber más, otra persona llegaba, investigaba y experimentaba para probar que aún había mucho más por aprender.
Me pregunto si el conocimiento que se tiene sobre la composición de los objetos está realmente completo.
Y, en realidad, si uno se detiene a meditarlo, lo único que se ha podido hacer son suposiciones cercanas de lo que en realidad es (ya que el átomo, hasta donde yo tengo entendido, no se ha podido ver).
Martínez Renata
3º "C"
Sec. 208
Bueno la verdad no le entendí muy bien, ya tenía sueño y pues no trabaja igual el cerebro, jaja...bueno ya entrando al tema, creo que la teoría de Dalton era similar a lo que en realidad es el átomo; pienso que fue un sujeto que en base a lo que ya se sabía del átomo, lo retomó y pudo acercarse muchísismo a lo que hoy en día se conoce como las características del átomo. Fue algo interesante esta actividad, realizar dibujos de bolitas XD pero se le entiende lo fundamental y lo que Daltón pensaba acerca del átomo.
Atte: León Jessica de 3ro "A"
hola profesor! la actividad me parecio muy interesante ya que me fue un poco dificil como hacer para cortar los liquidos...
resulta facinante como puede ser tan pequeño un atomo! ya tan importante para la ciencia!
me gusto la actividad!
me parecio muy interesante.
atte: mildred mOlina 3ro "C"
holaaa maestro puesm por lo de el video de rutherford no le entendi nada pues estaba en ingles per entendi que los electrones tienden a dispersarse a diferentes lugares bueno loa verdad yo me entendi jajajjaja bueno maestro lo dejo muchas gracias adioooooosss
Hola!
jaja comienzo a creer que soy yo el que no entiende el blog jaja estoy perdido! 0.o
Ummm creo que aqui debo poner el comentario de Börh no??
Okei realmente en Börh note que dedico mucho su tiempo a la clasificacion y orden del numero de protones y neutrones de cada nivel
No entiendo como supo el numero pero jaja por algo era fisico xD
Bueno hahaha no tengo mayor problema en copiar i pegar la actividad i las imagenes pero nunca he entendido que hacer con los comentarios!
perdon lo olvide el de arriba es mi comentario soy eduardo de tercero c
agg odio gmail -_-
Profesor no encuentro el lugar donde depositar mis comentarios!!
pff....
Espero que este bien aqui -_-
Okei ahora comentare sobre la actividad de anillos jeje
Ummm al principio no comprendi nada de lo que estaba leyendo lo ley varias veces para poder comprender lo que nesecitaba hacer para que el ejercicio quedara bien (espero yo que este bien xD)
Independientemente de eso tengo una duda
Todos los años publica la misma informacion en este blog?
porke me puse a chismear en los comentarios y vi algunos
que corresponden a alumnos de el año pasado xD
Uhh...
creo que es todo
Baae baae!
Att: Eduardo Villafuerte 3c
Raul torres gomez de 3ro c
El video d cantinflas me gusto mucho por la forma en como plantea los ejemplos y los entrelaza con el atomo,ademas creo que le encuentor parecido con algun profesor de quimica que conosco
Buenas noches prof!!
iiwal ya me hice bolas, todos dejan comentarios por donde sea. Ok bueno yo le dejaré el comentario final referente a todo el blog.
[[En verdad todo este desenlace acerca de la historia del átomo se me hizo super interesante y enigmático. Sin duda éste es un claro ejemplo de como algo que parece tan fácil, tiene tantas pregutas y dudas sin resolver, que para tratar de resolverlas ha abarcado tantos años de la historia y que aún hoy en día no se aia podido comprobrar. Al mismo tiempo es confuso imaginar que físico fué el más acertado, el más cercano o quizá el que de plano aia descubierto exactamente en sí como es la estructura de un átomo.
Ok, muy iinteresante y espero seguir sorprendiendome en su clase tal como me ha venido sucediendo!!]]
Atte: Jessica León de 3ro "A"
mmmm pues la verdad me parecioo muy interesante todo los temas que nos ha dadoo y por su puestoo lo que hayyy en su blogg por que la verdad es muy interesantee por quee comoo poder llegarrr a saber que en la primera capa del atomoo hay 2 despues 4 y asii la verdad es muy sorprenderte y la verdad me gustoo su blogg por que esta muy resumidoo y la verdad me da gustooo todoo lo que ha enseñadoo y su forma de dar la clasee por que la verdad estan perfeccionista que se tarda 2 años en dar una tarea buahahahahaha que sinceroo no??? pero asi es usted y me parecee buenoo gracias por todoo y excelente
CARLOS HAYS 3_A
p.d:!!!!!!!!HASTA EL HUEVOOO!!!!!!
3-B
Me gusta El Blog por , que nos ayuda ahora decirlo asi Estudiar Incidentalmente porq tiene imagenes, videos y letra legible y no me aburro y me mantiene entretenida y sabiendo mas sobre el atomo :) y es bueno saber q lo haga para nuestro bien ^^
RMJO.No24.3B-Me llamó la atención que todas son teorías, y que nadie ha visto en realidad un átomo.
Hola profesor soy GRJA 3"C" es muy bueno el blog y muy interesante en la manera que lo explica, esta muy completo.
Publicar un comentario